Sifat Koligatif Larutan Nonelektrolit
Mari kita pelajari sifat koligatif larutan non elektrolit :)
Namun sebelumya, apakahkalian masih mengingat apakah itu larutan non elektrolit?
Nah, benar sekali, larutan non elektrolit adalah larutan yang tidak dapat mengion secara semprna dan tidak dapat menghantarkan listrik.
Berikut sifat koligatif larutan non elektrolit:
Kalian tentu sudah mengetahui bahwa air memiliki titik didih 100 derajat Celcius. Ketika mendidih, air berubah menjadi uap air. Akan tetapi, air dapat menguap pada suhu berapa saja, termasuk dibawah 1000C. Pada keadaan jenuh, proses penguapan tetap berlangsung, tetapi pada saat yang sama terjadi pengembunan dengan laju yang sama. Dengan kata lain terdapat kesetimbangan dinamis antara zat cair dengan uap jenuhnya. Tekanan yang ditimbulkan oleh uap jenuh suatu zat disebut tekanan uap zat itu.
Mengapa terjadi penurunan tekanan uap?
Apabila ke dalam suatu pelarut dilarutkan zat yang tidak mudah menguap, ternyata tekanan uap jenuh larutan menjadi lebih rendah daripada tekanan uap jenuh pelarut murni. Sehingga penurunan tekana uap disebabkan oleh adanya zat terlarut yang sukar menguap. Dalam hal ini uap jenuh larutan dapat jenuh dianggap hanya mengandung uap zat pelarut, (lihat Gambar 1.2).
GAMBAR
Selisih antara tekanan uap jenuh pelarut murni dengan tekanan uap jenuh larutan disebut penurunan tekanan uap jenuh (P). Jika tekanan uap jenuh pelarut murni dinyatakan dengan P° dan tekanan uap jenuh larutan dengan P, maka P = P° – P.
Pada tahun 1880-an F.M. Raoult, seorang ahli kimia Perancis, menyatakan bahwa melarutkan zat terlarut mempunyai efek menurunkan tekanan uap dari pelarut. Adapun bunyi hukum Raoult yang berkaitan dengan penurunan tekanan uap adalah sebagai berikut.
Penurunan tekanan uap jenuh tidak bergantung pada jenis zat yang dilarutkan, tetapi tergantung pada jumlah partikel zat terlarut.
Penurunan tekanan uap jenuh berbanding lurus dengan fraksi mol zat yang dilarutkan.
Hukum Raoult tersebut dapat dirumuskan sebagai berikut.
P = P° . XB
Keterangan:
P = penurunan tekanan uap jenuh pelarut
XB = fraksi mol zat terlarut
P° = tekanan uap pelarut murni
Jika larutannya encer, nB << nA, sehingga nA + nB dapat dianggap sama dengan nA, jadi:
RUMUS
Keterangan:
nB = mol zat terlarut
nA = mol zat pelarut
WA = massa zat pelarut
WB = massa zat terlarut
Mr A = massa molekul zat pelarut
Mr B = massa molekul zat terlarut
Dalam larutan terdapat zat terlarut dan pelarut, sehingga:
XA + XB = 1
XB = 1 – XA
Jika tekanan uap pelarut dilambangkan P, di mana P < P°, maka:
ΔP = P° – P
P° – P = (1 – XA)PA°
P° – P = P° – XA. ΔP°
P = XA. ΔP°
Keterangan:
P = tekanan uap larutan
XA = fraksi mol pelarut
P° = tekanan uap pelarut murni
Hukum Raoult telah diuji kebenarannya dengan membandingkan harga P hasil eksperimen dengan P hasil hitungan berdasarkan rumus di atas. Antara hasil eksperimen dengan hasil hitungan terdapat perbedaan yang kecil karena kesalahan dalam pengamatan.
Titik didih adalah titik atau suhu yang menunjukkan tepat mendidihnya suatu zat. Titik beku adalah titik atau suhu yang menunjukkan tepat membekunya suatu zat. Contoh: titik didih air adalah 100°C dan titik beku air adalah 0° C.
Mengapa terjadi kenaikan titik didih dan penurunan titik beku?
Setiap zat cair pada suhu tertentu mempunyai tekanan uap jenuh tertentu dan mempunyai harga yang tetap. Pada saat udara mempunyai tekanan 1 atm, air mendidih pada suhu 100°C, tetapi melalui percobaan telah diketahui bahwa larutan dari zat-zat yang sukar menguap mempunyai titik didih lebih tinggi dan titik beku lebih rendah dari pelarutnya.
Selisih antara titik didih suatu larutan dengan titik didih pelarut murni disebut kenaikan titik didih larutan (ΔTb).
-
Selisih temperatur titik beku larutan dengan titik beku pelarut murni disebut penurunan titik beku (ΔTf).
-
Hukum Backman dan Raoult bahwa penurunan titik beku dan kenaikan titik didih berbanding langsung dengan molalitas yang terlarut di dalamnya. Hukum tersebut dapat dirumuskan sebagai berikut.
RUMUS
Keterangan:
ΔTb = kenaikan titik didih
Kb = tetapan kenaikan titik didih molal
ΔTf = penurunan titik beku
Kf = tetapan titik beku molal
m = molalitas
Syarat Hukum Backman dan Raoult adalah sebagai berikut.
a. Rumus di atas berlaku untuk larutan nonelektrolit.
b. ΔTb tidak berlaku untuk larutan yang mudah menguap.
c. Hanya berlaku untuk larutan yang sangat encer, pada larutan yang pekat terdapat penyimpangan.
Apa saja penggunaan kenaikan titik didih dan penurunan titik beku?
-
Membuat Es puter
-
Membuat campuran pendingin
-
Antibeku
-
Pencairan salju di jalan raya
Diagram fase atau diagram P-T adalah diagram yang menyatakan hubungan antara suhu dan tekanan dengan fase zat, Diagram fase menyatakan batas-batas suhu dan tekanan dimana suatu bentuk fase dapat diambil.
Berikut diagram fase larutan relatif terhadap pelarutnya:
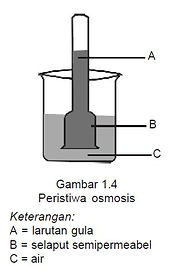
Osmosis adalah peristiwa mengalirnya molekulmolekul pelarut ke dalam larutan secara spontan melalui selaput semipermeabel, atau peristiwa mengalirnya molekul-molekul zat pelarut dari larutan yang lebih encer ke larutan yang lebih pekat. Proses osmosis terdapat kecenderungan untuk menyetimbangkan konsentrasi antara dua larutan yang saling berhubungan melalui membran. Mengapa terjadi tekanan osmosis?
Perhatikan peristiwa osmosis pada gambar 1.4!
Gambar 1.4 tersebut menunjukkan osmometer yang diisi larutan gula, kemudian dimasukkan ke dalam gelas kimia yang berisi air, ternyata permukaan larutan gula pada osmometer naik. Akan tetapi, jika di atas torak diberi beban tertentu, maka aliran air ke dalam osmometer dapat dicegah.
Gaya yang diperlukan untuk mengimbangi desakan zat pelarut yang mengalir melalui selaput semipermeable ke dalam larutan disebut tekanan osmosis larutan. Hubungan tekanan osmosis dengan kemolaran larutan oleh Van’t Hoff dapat dirumuskan sebagai berikut.
rumus
Keterangan:
= tekanan osmosis (atm)
M = molaritas (mol/liter)
T = suhu mutlak (K)
R = ketetapan gas (0,082) L.atm.mol–1K–1
Hukum Van’t Hoff ini hanya berlaku pada larutan nonelektrolit.
Apa saja penggunaan tekanan osmosis?
-
Pada sel darah merah
-
Infus
-
Fotosintesis
Soal Latihan
-
Manitol sebanyak 18,04 gram dilarutkan dalam 100 gram air pada suhu 20 °C. Ternyata tekanan uap jenuh larutan adalah 17,227 mmHg. Jika tekanan uap air jenuh pada suhu itu 17,54 mmHg, hitunglah massa molekul manitol!
-
Tentukan titik didih dan titik beku larutan berikut!a.urea (CO(NH2)2) 30 gram dalam 500 gram air.b.glukosa (C6H12O6) 18 gram dalam 10 gram air.
-
Titik beku larutan 64 gram naftalena dalam 100 gram benzena adalah 2,91 °C. Jika titik beku benzena 5,46°C dan tetapan titik beku molal benzena 5,1 °C, maka tentukan massa molekul relatif naftalena!
-
Berapa berat gula yang harus dilarutkan untuk menaikkan titik didih 250 mL air menjadi 100,1°C pada tekanan 1 atm, jika Mr gula = 342 dan Kb = 0,5 °C/m
1. Penurunan Tekanan Uap
2. Kenaikan Titik Didih (ΔTb) dan Penurunan Titik Beku (ΔTf)
3. Diagram Fase atau Diagram P-T
4. Tekanan Osmosis Larutan
b.

a.